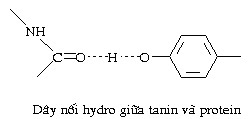
II. PHÂN LOẠI:
Có thể chia làm 2 loại chính:
Tanin thuỷ phân được hay tanin pyrogallic. Loại tanin này có những đặc điểm sau:
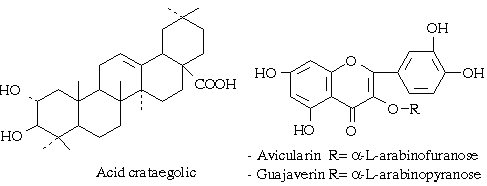
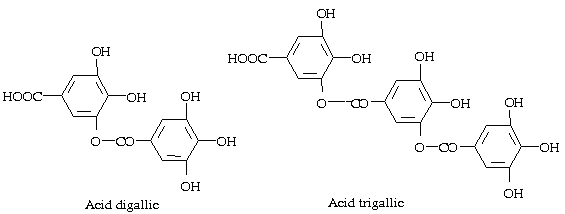
- Khi thuỷ phân bằng acid hoặc bằng enzym tanase thì giải phóng ra phần đường thường là glucose, đôi khi gặp đường đặc biệt ví dụ đường hamamelose (xem công thức hamamelitanin ở phần dưới). Phần không phải là đường là các acid.Acid hay gặp là acid gallic. Các acid gallic nối với nhau theo dây nối depsid để tạo thành acid digallic, trigallic.
Ngoài acid gallic ra người ta còn gặp các acid khác ví dụ acid ellagic, acid luteolic, acid hexahydroxydiphenic (dạng mở 2 vòng lacton của acid ellagic), acid chebulic.
Phần đường và phần không phải đường nối với nhau theo dây nối ester (không phải dây nối acetal) nên người ta coi tanin loại này là những pseudoglycosid.
- Khi cất khô ở 180-200oC thì thu được pyrogallol là chủ yếu.
- Cho tủa bông với chì acetat 10%.
- Cho tủa màu xanh đen với muối sắt ba.
- Thường dễ tan trong nước.
Dưới đây là ví dụ một số tanin thuộc loại pyrogallic:
+ Tanin của ngũ bội tử Âu. Công thức tanin này đã được sửa đổi nhiều lần. Theo Fisher, công thức là penta-O-galloyl-glucose.
Britton (1966) đưa ra công thức: 1,3,4,6 tetra-O-galloyl 2m.trigalloyl b-D- glucose.
Theo Z.Sh.Buziasvili (1973) thì cho rằng tanin của ngũ bội tử Âu có gốc acid gallic gồm một trigalloyl, một digalloyl và hai monogalloyl còn OH bán acetal của glucose thì tự do.
+ Tanin của lá và vỏ cây Hamamelis virginiana L. là hamamelitanin với phần đường là hamamelose (= hydroxy-methyl- D-ribose) công thức đã được Schmidt xác lập năm 1935 và đã được Mayer xác định lại năm 1965.
+ Tanin trong một số cây thuộc chi Terminalia: acid chebulinic và acid chebulagic.
+ Một số nguyên liệu khác có chứa tanin thuỷ phân được: Đại hoàng, đinh hương, cánh hoa hồng đỏ, vỏ quả và vỏ cây lựu, lá cây bạch đàn.
Tanin ngưng tụ hay còn được gọi là tanin pyrocatechic
Loại tanin này có những đặc điểm sau:
- Dưới tác dụng của acid hoặc enzym dễ tạo thành chất đỏ tanin hay phlobaphen. Phlobaphen rất ít tan trong nước là sản phẩm của sự trùng hiệp hoá kèm theo oxy hoá, do đó tanin pyrocatechic còn được gọi là phlobatanin. Phlobaphen là đặc trưng của một số dược liệu như vỏ canh ki na, vỏ quế...
- Khi cất khô thì cho pyrocatechin là chủ yếu.
- Cho tủa màu xanh lá đậm với muối sắt ba.
- Cho tủa bông với nước brom.
- Khó tan trong nước hơn tanin pyrogallic.
Tanin ngưng tụ được biết nhiều trong các chi Acacia, Camellia, Cinchona, Cinnamomum, Colophospermum, Rheum, Salix...
Tanin nhóm này được tạo thành do sự ngưng tụ từ các đơn vị flavan -3-ol hoặc flavan 3,4-diol. Những tanin đơn giản thuộc loại này đã được nói đến trong phần đại cương về flavonoid. Có tác giả gọi tanin ngưng tụ thuộc loại này là các proanthocyanidin.
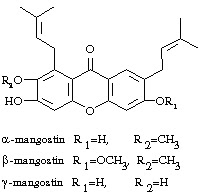
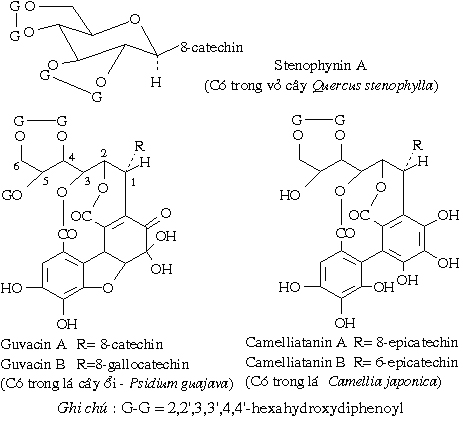
Sau đây trình bày thêm một số chất tanin đặc biệt, những chất tanin này có sự kết hợp giữa tanin ngưng tụ và tanin thuỷ phân được . Đây là những gallo và ellagiflavotanin. Dưới đây là một số ví dụ:
Trong cấu trúc của các tanin vừa nêu trên ta thấy có đơn vị catechin hoặc epicatechin hoặc gallocatechin nối theo dây nối O-glycosid ở C-1 của đường, còn các dẫn chất hydroxydiphenic acid nối theo dây nối ester với phần đường.
Cũng cần chú ý rằng trong một số nguyên liệu thực vật có thể có mặt
ca hai loại tanin thuỷ phân được và tanin ngưng tụ ví dụ lá cây thuộc chi
Hamamelis, rễ đại hoàng...
www.duoclieu.org
TÀI LIỆU THAM KHẢONgô Văn Thu (2011), “Bài giảng dược liệu”, tập I. Trường đại học Dược Hà Nội
Phạm Thanh Kỳ (1998), “Bài giảng dược liệu”, tập II. Trường đại học Dược Hà Nội
Đỗ Tất Lợi (2004), “Những cây thuốc và vị thuốc Việt Nam”, Nhà xuất bản Y học
Viện dược liệu (2004), “Cây thuốc và động vật làm thuốc ở Việt Nam”, tập I, Nhà xuất bản khoa hoc kỹ thuật.
Viện Dược liệu (2004), “Cây thuốc và động vật làm thuốc Việt Nam”, tập II, Nhà xuất bản Khoa học kỹ thuật