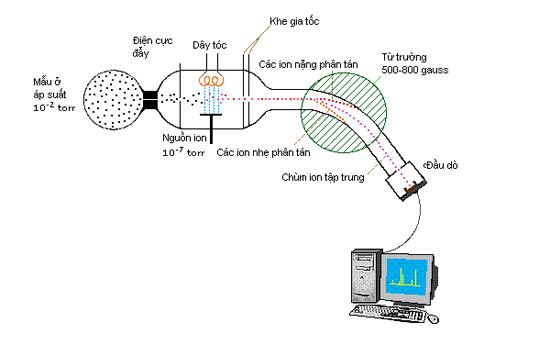
SÂM NGỌC LINH
Tên khoa học:
Panax vietnamensis Ha et Grushv-họ Nhân sâm Araliaceae
Tên thường gọi: Sâm Ngọc Linh, sâm Việt Nam, sâm Khu Năm (sâm K5), sâm trúc (sâm đốt trúc, trúc tiết nhân sâm)
Trước khi có sự phát hiện từ phía các nhà khoa học, sâm Ngọc Linh đã được các đồng bào dân tộc thiểu số Trung Trung bộ
Việt Nam, đặc biệt là dân tộc Xê Đăng, sử dụng như một loại củ rừng, mà họ gọi là củ ngải rọm con hay cây thuốc giấu, chữa nhiều loại bệnh theo các phương thuốc cổ truyền. Dựa trên những thông tin lưu truyền trong cộng đồng các dân tộc thiểu số Quảng Nam, Kon Tum về một loại củ quý hiếm trên núi Ngọc Linh có tác dụng tốt đối với sức khỏe con người, và do nhu cầu của kháng chiến đã khiến ngành dược khu Trung Trung Bộ quyết phải tìm ra cây sâm chi Panax tại miền Trung, mặc dù trước đó nhiều nhà khoa học cho rằng chi Panax chỉ có ở miền Bắc.
Năm 1973, khu Y tế Trung Trung bộ cử một tổ 4 cán bộ do dược sĩ Đào Kim Long làm trưởng đoàn, kỹ sư Nguyễn Bá Hoạt, dược sĩ Nguyễn Châu Giang, dược sĩ Trần Thanh Dân là thành viên, đi điều tra phát hiện cây sâm theo hướng chân núi Ngọc Linh thuộc huyện Đắc Tô tỉnh Kon Tum. Khi đoàn lên tỉnh Kon Tum, Ban Dân y Kon Tum cử thêm dược tá Nguyễn Thị Lê trợ giúp cho đoàn, dẫn đường lên núi Ngọc Linh. Sau nhiều ngày vượt suối băng rừng, đến 9 giờ sáng ngày 19 tháng 03 năm 1973, ở độ cao 1.800 mét so với mặt biển, đoàn đã phát hiện hai cây sâm đầu tiên và ngay buổi chiều cùng ngày đã phát hiện được một vùng sâm rộng lớn thuộc phía Tây núi Ngọc Linh. Sau 15 ngày nghiên cứu toàn diện về hình thái, sinh thái, quần thể, quần lạc, phân bố, di cư và phát tán, dược sĩ Đào Kim Long đã xác định núi Ngọc Linh là quê hương của cây sâm mới, đặc biệt quý hiếm, chưa từng xuất hiện tại bất cứ nơi nào khác trên thế giới. Theo đánh giá của Tiến sĩ Trần Chí Liêm, Thứ trưởng Bộ Y tế Việt Nam: đây là cống hiến quan trọng cho khoa học, bổ sung tri thức mới về vùng phân bố chi Panax xuống tới vĩ tuyến 15 và bổ sung cho chi Panax họ Araliaceae một loài mới. Sau khi sâm được phát hiện, Khu uỷ Khu 5 đã chỉ đạo Ban Dân y bí mật bảo vệ và khai thác, giao cho xưởng Dược Trung Trung Bộ chế biến làm thuốc phục vụ cán bộ, chiến sĩ và nhân dân; đồng thời gửi mẫu ra Bộ Y tế, Viện Dược liệu Hà Nội nghiên cứu.
Những năm sau khi hòa bình lập lại, tháng 10 năm 1978 một tổ công tác thứ hai lên vùng núi Ngọc Linh với nhiệm vụ ước lượng sơ bộ diện tích sâm mọc. Kết quả chuyến đi là việc tìm ra được một vùng dài hàng chục kilômét, có trữ lượng khoảng 6.000-7.000 cây sâm mọc dày đặc với mật độ từ 1 mét vuông một cây đến 7,8 mét vuông một cây.
Nǎm 1979, Trung tâm Y tế Quảng Nam tổ chức điều tra ở 5 xã của huyện Trà My với sự giúp đỡ của Đại học Y Dược Thành phố Hồ Chí Minh. Kết quả đợt điều tra là việc tìm thấy 1.337 cây trong 211 ô tiêu chuẩn. Trọng lượng trung bình thân rễ sâm là 5,26 gam; số thân có trọng lượng trên 25 gam là 7,39% và số thân rễ có trên 10 sẹo (ước tính trên 8 năm tuổi) là 36,9%. Đợt điều tra này đã thu được 1 thân rễ có tới 52 sẹo (ước tính cây trên 50 năm tuổi), đường kính 1,2 cm, tuy đây chưa phải là thân rễ sống lâu nhất. Trong những đợt tìm kiếm, điều tra về sau còn phát hiện ra cây khoảng 82 năm tuổi có rễ, củ và thân rễ dài hơn nửa mét.
Sâm Ngọc Linh có dạng thân khí sinh thẳng đứng, màu lục hoặc hơi tím, nhỏ, có đường kính thân độ 4-8mm, thường tàn lụi hàng năm tuy thỉnh thoảng cũng tồn tại một vài thân trong vài năm. Thân rễ nhiều đốt mang sẹo của những gốc thân mọc hàng năm lụi đi. Chiều dài và đường kính thân rễ thay đổi tùy theo độ tuổi của cây, thường dài 25cm, đường kính 1 – 3,5cm với cây khoảng 20 năm tuổi. Thân rễ cũng mang nhiều
rễ nhánh và
củ. Các thân mang
lávà tương ứng với mỗi thân mang lá là một đốt dài khoảng 0,5-0,7 cm, tuy sâm chỉ có một lá duy nhất không rụng suốt từ năm thứ 1 đến năm thứ 3 và chỉ từ năm thứ 4 trở đi mới có thêm 2 đến 3 lá. Trên đỉnh của thân mang lá là lá kép hình chân vịt mọc vòng với 3-5 nhánh lá. Cuống lá kép dài 6-12mm, mang 5 lá chét, lá chét ở chính giữa lớn hơn cả với độ dài 12–15 cm, rộng 3–4 cm. Lá chét phiến hình bầu dục, mép khía răng cưa, chóp nhọn, lá có lông ở cả hai mặt. Cây 4-5 năm tuổi có hoa hình tán đơn mọc dưới các lá thẳng với thân, cuống tán hoa dài 10–20 cm có thể kèm 1-4 tán phụ hay một hoa riêng lẻ ở phía dưới tán chính. Mỗi tán có 60-100 hoa, cuống hoa ngắn 1-1.5 cm, lá đài 5, cánh hoa 5, màu vàng nhạt, nhị 5, bầu 1 ô với 1 vòi nhụy. Quả mọc tập trung ở trung tâm của tán lá, dài độ 0,8 cm-1 cm và rộng khoảng 0,5 cm-0,6 cm, sau hai tháng bắt đầu chuyển từ màu xanh đến xanh thẫm, vàng lục, khi chín ngả màu đỏ cam với một chấm đen không đều ở đỉnh quả. Quả hình thận và phần lớn chỉ chứa một hạt, và số quả trên cây bình quân khoảng 10 đến 30 quả.
Đặc điểm về mặt thực vật được phân biệt với các loại Panax khác ở chỗ loài này phần lớn là bầu 1 ô, một vòi nhụy, thỉnh thoảng cũng có trường hợp 2 ô nhưng không có 3 ô hoặc hơn. Trái hình thận và phần lớn chỉ chứa một hạt trong lúc các loài khác thường có 2 hạt hoặc hơn.
Phân bố: là loại sâm quý được tìm thấy tại miền Trung Trung Bộ Việt Nam, mọc tập trung ở các huyện miền núi Ngọc Linh thuộc huyện Đăk Tô tỉnh Kon Tum, huyện Trà My tỉnh Quảng Nam. Ngoài Ngọc Linh, sâm còn phân bố tại núi Ngọc Lum Heo thuộc xã Phước Lộc, huyện Phước Sơn và còn có thể có ở đỉnh Ngọc Am tỉnh Quảng Nam theo những kết quả điều tra mới nhất. Trên độ cao 1.200 đến 2.100m, sâm Ngọc Linh mọc dày thành đám dưới tán
rừng dọc theo các suối ẩm trên đất nhiều mùn.
Trồng trọt: Mọc dưới tán rừng ẩm, nhiều mùn, thích hợp với nhiệt độ ban ngày từ 20°C-25°C, ban đêm 15°C-18°C, sâm Ngọc Linh có thể sống rất lâu, sinh trưởng khá chậm. Bộ phận dùng làm thuốc chủ yếu là thân rễ, củ và ngoài ra cũng có thể dùng lá và rễ con. Vào đầu tháng 1 hàng năm, sâm xuất hiện chồi mới sau mùa ngủ đông, thân khí sinh lớn dần lên thành cây sâm trưởng thành có 1 tán hoa. Từ tháng 4 đến tháng 6, cây nở hoa và kết quả. Tháng 7 bắt đầu có quả chín và kéo dài đến tháng 9. Cuối tháng 10, phần thân khí sinh tàn lụi dần, lá rụng, để lại một vết sẹo ở đầu củ sâm và cây bắt đầu giai đoạn ngủ đông hết tháng 12. Chính căn cứ vào vết sẹo trên đầu củ mỗi mùa đông đến mà người ta có thể nhận biết cây sâm bao nhiêu tuổi, phải ít nhất 3 năm tuổi tức trên củ có một sẹo (sau 3 năm đầu sâm chỉ rụng một lá) mới có thể khai thác.
Từ năm 1973 đến nay, đã có nhiều cơ quan, nhà khoa học trong và ngoài nước nghiên cứu về sâm Ngọc Linh, và gần 50 nghiên cứu sinh đã bảo vệ thành công luận án phó tiến sĩ, tiến sĩ từ các công trình nghiên cứu về loài cây quý hiếm này, tiêu biểu gồm có:
- 1990: Nguyễn minh Đức, Yamasaki K. (Viện nghiên cứu khoa học Dược, Trường đại học
YHiroshima - Nhật). Phân lập và xác định cấu trúc 49 saponin trong Sâm Việt Nam, phát hiện 24 saponin mới, đặt tên VG.R1-R24.
- 1999-2001: Võ duy Huấn, Yamasaki, K. (Viện nghiên cứu khoa học Dược, Trường đại học Y Hiroshima – Nhật ). Phân lập và xác định cấu trúc 19 saponin trong lá Sâm Việt Nam, phát hiện 8 saponin mới đặt tên VG.L1-L8.
- 1999-2001: Trung tâm Sâm và Dược liệu Tp. HCM và Sở Y tế Quảng Nam. Tiêu chuẩn hóa nguyên liệu: phần thân rễ và rễ củ (đã đưa vào Dược điển Việt nam tập 3) và phần lá (dự thảo).
- 2001-2002: Trần lê Quan, Kadota, S.( Viện nghiên cứu Y học phương đông, Trường đại học Y Dược Toyama, Nhật bản.). Phát hiên thêm 3 saponin và 1 genin trong Sâm Việt Nam, 2 saponin mới là 20-O-Me-G.Rh1 và VG-R25.
Hợp chất saponin được xem là thành phần hoạt chất chủ yếu của cây Sâm Việt Nam cũng như của các loài sâm khác trên thế giới. Từ phần dưới mặt đất của Sâm Việt Nam hoang dại đã phân lập và xác định được cấu trúc protopanaxadiol oxid II và 52 hợp chất saponin bao gồm 26 saponin đã biết và 26 saponin có cấu trúc mới được đặt tên là vina-ginsenoside-R1-R24 và 20- O-Me-G.Rh. Các saponin dammaran được xem là hoạt chất quyết định cho các tác dụng sinh học có gía trị của Sâm Triều tiên cũng chiếm một tỉ lệ rất cao về hàm lượng và số lượng trong thành phần hợp chất saponin của Sâm Việt Nam (50/52saponin được phân lập). Trong đó các saponin dẫn chất của 20(S)-protopanaxadiol gồm 22 hợp chất với các đại diện chính là: ginsenoside-Rb1, -Rb3, -Rd. Các saponin dẫn chất của 20(S)-protopanaxatriol gồm 17 hợp chất với các đại diện chính là: ginsenoside- Re, -Rg1, notoginsenoside –R1. Các saponin có cấu trúc ocotillol gồm 11 hợp chất với các đại diện chính là: majonoside –R1 và –R2. Đặc biệt M-R2 chiếm gần 50% hàm lượng saponin toàn phần từ phần dưới mặt đất của Sâm Việt Nam và trở thành một hợp chất chủ yếu của Sâm Việt Nam so với thành phần saponin trong các loài sâm khác trên thế giới và gấp 48 lần hiệu suất chiết được từ Đại diệp tam thất (Panax japonicum C.A. Mey. Var. major (Burk.) C.Y.Wu et K.M.Feng. Hai saponin dẫn chất của acid oleanolic chỉ chiếm một tỉ lệ rất thấp với hemsloside –Ma3 được phát hiện đầu tiên trong một loài Panax thuộc họ Nhân sâm. Hợp chất này trước đây đã được phân lập từ Hemsleya macrosperma C.Y.Wu họ Bầu bí Cucurbitaceae.
Như vậy, sâm Việt Nam là một trong những loại sâm có hàm lượng saponin nhiều nhất, tương tự một số cây sâm quý đã từng được nghiên cứu sử dụng từ lâu trên thế giới… Hợp chất hóa học đa dạng và tác dụng thực tiễn đối với sức khỏe của con người khiến sâm Ngọc Linh hiện nay được bán trên thị trường với giá càng ngày càng cao, thậm chí còn cao hơn sâm Triều Tiên nhiều lần.
Ngoài ra trong sâm Ngọc Linh còn có 17 acid béo, 17 acid amin (bảng 1) trong đó có 8 acid amin không thay thế được và 20 nguyên tố đa lượng, vi lượng.
Bảng 1: Thành phần acid amin :
STT | Acid amin | Acid amin tự do(%) | Axit amin thủy giải (%) |
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17
| Tryptophan Lysin Histidin Arginin Axit Aspartic Threonin Serin Axit Glutamic Prolin Glycin Alanin Cystin Valin Methionin Isoleucin Tyrosin Phenylanin | 10,20 17,9 1,02 46,66 7,60 1,20 5,12 2,05 3,07 4,10 - 1,53 0,51 0,51 1,02 0,51 0,51 | - 5,29 2,59 12,90 10,38 5,19 5,19 6,49 15,58 5,19 5,19 vết 1,29 vết 2,59 5,19 6,49 |
Trước khi có những nghiên cứu kỹ lưỡng về tác dụng đối với sức khỏe của sâm Ngọc Linh, sâm đã được các dân tộc thiểu số Việt Nam, như người Xê Đăng, dùng như một loại thuốc trong những bài thuốc cổ truyền cầm máu, lành vết thương, làm thuốc bổ, sốt rét, đau bụng, phù thũng.
Công bố của Viện Dược liệu Việt Nam, cho thấy sâm Ngọc Linh có tác tác dụng chống stress vật lý, stress tâm lý và trầm cảm, kích thích hệ miễn dịch, chống oxy hóa, lão hóa, phòng chống ung thư, bảo vệ tế bào gan. Bên cạnh đó, sâm Ngọc Linh cũng có tác dụng giúp người bệnh ăn ngon, ngủ tốt, lên cân, tăng thị lực, hoạt động trí tuệ và thể lực cải thiện, gia tăng sức đề kháng, cải thiện các trường hợp suy nhược thần kinh và suy nhược sinh dục, nâng cao huyết áp ở người bị huyết áp thấp, chống ôxi hóa, lão hóa, phòng chống ung thư, bảo vệ tế bào gan.
Nghiên cứu dược lý lâm sàng của sâm
Ngọc Linh cũng cho kết quả tốt: bệnh nhân ăn ngon, ngủ tốt, lên cân, tăng thị lực, hoạt động trí tuệ và thể lực cải thiện, gia tăng sức đề kháng, cải thiện các trường hợp suy nhược thần kinh và suy nhược sinh dục, nâng cao huyết áp ở người bị huyết áp thấp. Ngoài những tác dụng như trên, theo dược sĩ Đào Kim Long, sâm Ngọc Linh có những tính năng tuyệt hảo như tăng lực, phục hồi sự suy giảm chức năng giúp cho tình trạng của cơ thể trở lại bình thường; kháng các độc tố gây hại tế bào, giúp kéo dài sự sống của tế bào và tăng các tế bào mới. Đặc biệt, sâm Ngọc Linh có những tính năng mà sâm Triều Tiên và sâm Trung Quốc không có là tính kháng khuẩn, chống trầm cảm, giảm lo âu, chống oxy hóa.
6. Nghiên cứu và phát triển sản phẩm từ Sâm Ngọc Linh
Từ các kinh nghiệm dân gian và các công trình nghiên cứu, Trạm nghiên cứu dược liệu Tỉnh Quảng Nam - Đà Nẵng (trước đây) và Xí nghiệp dược phẩm Đà Nẵng đã chế các dược phẩm như tinh sâm quy Ngọc Linh, sâm quy mật ong... có chứa sâm Ngọc Linh.
Trung tâm Khoa học sản xuất Sâm Việt Nam thuộc Bộ Y tế đã nghiên cứu và đưa ra thị trường các chế phẩm từ cây sâm này, như Vinaginseng pastilles, mỗi viên chứa 12mg saponin Sâm Việt Nam; Vinapanax viên (viên ngậm) chứa 10mg saponin Sâm Việt Nam, mỗi viên và sâm quy dưỡng lực với một số dược liệu khác (bạch truật, đương quy, thục địa, cam thảo…); thuốc Vina-ginseng extractum có nhiều công dụng quý như bổ toàn thân, trị suy nhược cơ thể, bổ thần kinh và sinh dục, tǎng sức, trí nhớ...
Ngoài ra còn có các chế phẩm khác từ Sâm Ngọc Linh như: rượu sâm, sâm ngâm mật ong, sâm khô cắt lát, sâm tươi…
Sau khi dược tính và tác dụng đối với sức khỏe của sâm Ngọc Linh được công bố công khai trên các phương tiện thông tin đại chúng, những năm 80 của thế kỷ 20, trên thị trường tự do giá sâm Ngọc Linh tương đương giá sâm Triều Tiên và vào những năm 90, giá sâm Ngọc Linh còn đắt hơn sâm Triều Tiên nhiều lần. Theo dược sĩ Đào Kim Long thì ngay cả dân Hàn Quốc, Nhật Bản, xứ sở của sâm, cũng qua đây tìm cho được sâm Ngọc Linh để chữa bệnh. Việc khai thác, mua bán và sử dụng tràn lan chưa có quy định quản lý, bảo vệ cùng các chính sách, giải pháp đầu tư, quy hoạch phát triển khiến trên 108 vùng sâm mọc tự nhiên giữa Quảng Nam và Kon Tum dần cạn kiệt, kéo theo hàng ngàn hecta rừng nguyên sinh bị tàn phá nặng nề.
Trước nguy cơ tuyệt chủng của giống sâm quý, Chính phủ Việt Nam đã quyết định thành lập vùng cấm quốc gia ở khu vực có
sâm mọc tập trung tại 2 tỉnh Kon Tum và Quảng Nam, đồng thời xếp sâm Ngọc Linh vào danh sách các loại cây cấm khai thác, mua bán bất hợp pháp.
Nhận thức đúng đắn về giá trị kinh tế, xã hội, khoa học và môi trường của cây sâm Ngọc Linh, cách đây gần 30 năm tỉnh Kon Tum đã xác định đây là cây hàng hóa chủ lực có lợi thế cạnh tranh cao trong chiến lược phát triển kinh tế - xã hội của tỉnh. Thực hiện ý kiến chỉ đạo của Tỉnh Ủy, HĐND-UBND tỉnh, trong những năm qua, Sở Khoa học và Công nghệ đã phối hợp các ngành liên quan, các nhà khoa học trong và ngoài tỉnh triển khai nhiều đề tài, dự án nghiên cứu việc bảo tồn và phát triển cây sâm Ngọc Linh.
Năm 2001, Sở Khoa học và Công nghệ tỉnh Kon Tum đã phối hợp với Viện Dược liệu (Bộ Y tế), Trung tâm Nghiên cứu trồng và Chế biến cây thuốc (Hà Nội), Lâm trường Ngọc Linh ( nay là Công ty TNHH MTV Đăk Tô) triển khai thực hiện dự án “Nghiên cứu hoàn thiện công nghệ sản xuất giống, kỹ thuật trồng và quy hoạch phát triển cây sâm Ngọc Linh tại Kon Tum”. Dự án đã tập trung xây dựng vườn sâm giống (ở độ cao 1.900 - 2.000 m) trên diện tích gần 1,12ha với hơn 60.000 cây sâm giống để phát triển vùng sâm trồng của tỉnh. Đồng thời, đã chuyển giao trên 13.550 cây sâm giống cho 24 hộ gia đình tại xã Ngọc Lây (huyện Tu Mơ Rông) trồng thử nghiệm để triển khai nhân rộng. Thông qua dự án cũng đã xây dựng được quy trình nhân giống bằng hạt và quy trình kỹ thuật trồng sâm bán tự nhiên, phát triển mô hình đến các hộ nông dân vùng sâu, vùng xa, từng bước nghiên cứu trồng sâm ở mô hình trang trại để phát triển nhanh diện tích trồng sâm Ngọc Linh và đề xuất quy hoạch phát triển. Đã tiến hành quy hoạch sơ bộ tại các xã Măng Ri, Ngọc Lây, Ngọc Yêu, Đăk Na, Mường Hoong, Ngọc Linh với diện tích 66.830 ha, ở nhiệt độ trung bình năm 180C ; ẩm độ từ 82 - 87% và độ cao trung bình từ 2.100 - 2.800m, tại các tọa độ địa lý : 16o38’ - 16o85’ độ vĩ Bắc và 107o99’ - 108o40’ độ kinh Đông. Kết quả của dự án bước đầu đã khôi phục vườn sâm giống có khả năng cung cấp giống mở rộng qui mô trong thời gian tới. Mô hình trồng sâm trên vùng sinh trưởng tự nhiên và bán tự nhiên cho thấy cây sâm sinh trưởng và phát triển tốt, đầu tư ít, mang lại hiệu quả kinh tế cao. Sâm giống được giao cho từng hộ gia đình trồng, chăm sóc và quản lý đã phát huy được ý thức trách nhiệm của từng hộ. Đây là mô hình nếu được đầu tư thỏa đáng sẽ mang lại hiệu quả thiết thực, góp phần xóa đói giảm nghèo cho các hộ gia đình sống ở vùng núi Ngọc Linh.
Năm 2006, Bộ Khoa học và Công nghệ phê duyệt đề tài: Nghiên cứu nhân giống vô tính và sản xuất sinh khối rễ cây sâm Ngọc Linh, với tổng kinh phí đầu tư 1,7 tỷ đồng. Viện Sinh học Tây nguyên đã phối hợp với Trung tâm ứng dụng và chuyển giao công nghệ tỉnh Kon Tum đã nghiên cứu nhân giống
in vitro cây Sâm Ngọc Linh và trồng thử nghiệm cây Sâm nuôi cấy mô ra tại xã Tê Xăng (huyện Tu Mơ Rông) và Bidunop Núi Bà (Lâm Đồng). Kết quả đề tài bước đầu cho thấy cây sâm Ngọc Linh nuôi cấy mô đã sinh trưởng và phát triển tốt trên những vùng có hệ sinh thái đặc trưng tương đồng với các điều kiện sinh thái của cây sâm Ngọc Linh sống ngoài tự nhiên không những ở quanh đỉnh Ngọc Linh mà được di thực trồng tại Bidunop Núi Bà ( Lâm Đồng) cũng cho kết quả khả quan. Trong thời gian không xa nữa đề tài hoàn tất tháng 7/2011, chúng ta có thể chủ động được nguồn giống sâm Ngọc Linh với qui mô lớn và chọn được cây giống tiêu chuẩn. Đồng thời công nghệ sản xuất sinh khối rễ sâm bằng hệ thống Bioractor được triển khai nhân rộng mô hình thành sản phẩm hàng hóa.